| 技術名稱 | 以核殼蛋白非典型交界面為標靶開發抗冠狀病毒藥物 | ||
|---|---|---|---|
| 計畫單位 | 國立中興大學 | ||
| 計畫主持人 | 侯明宏 | ||
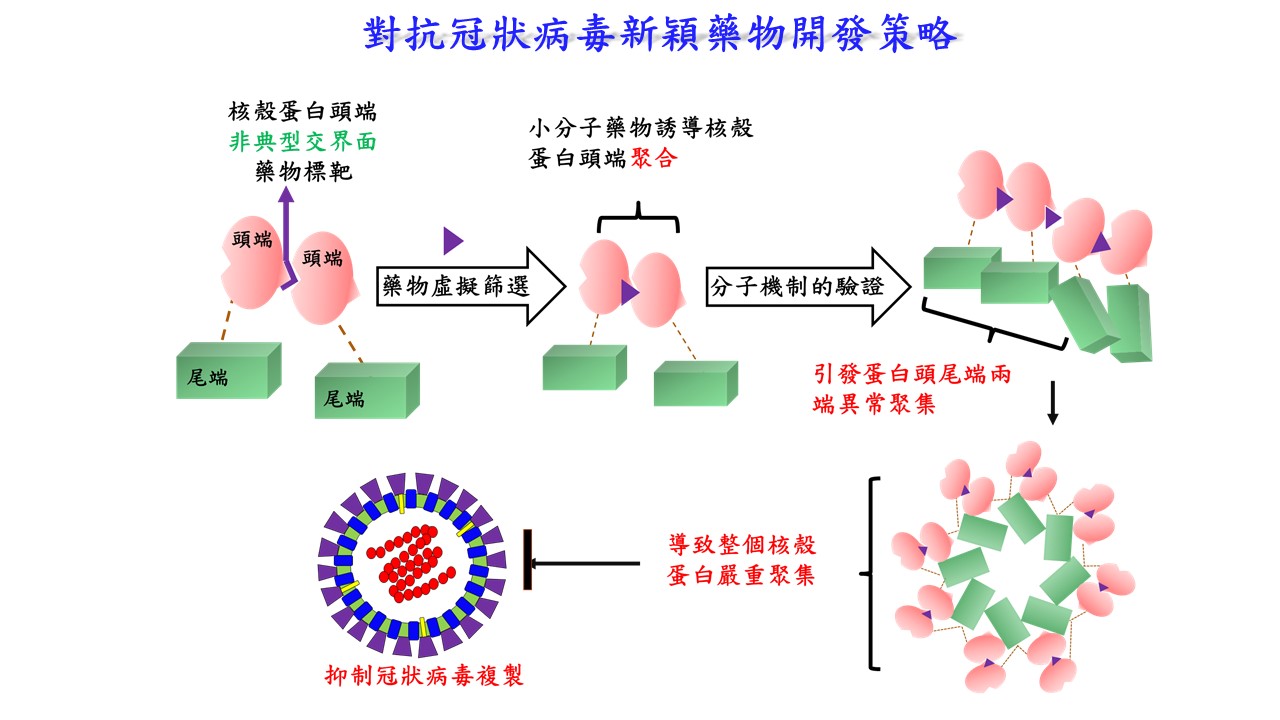
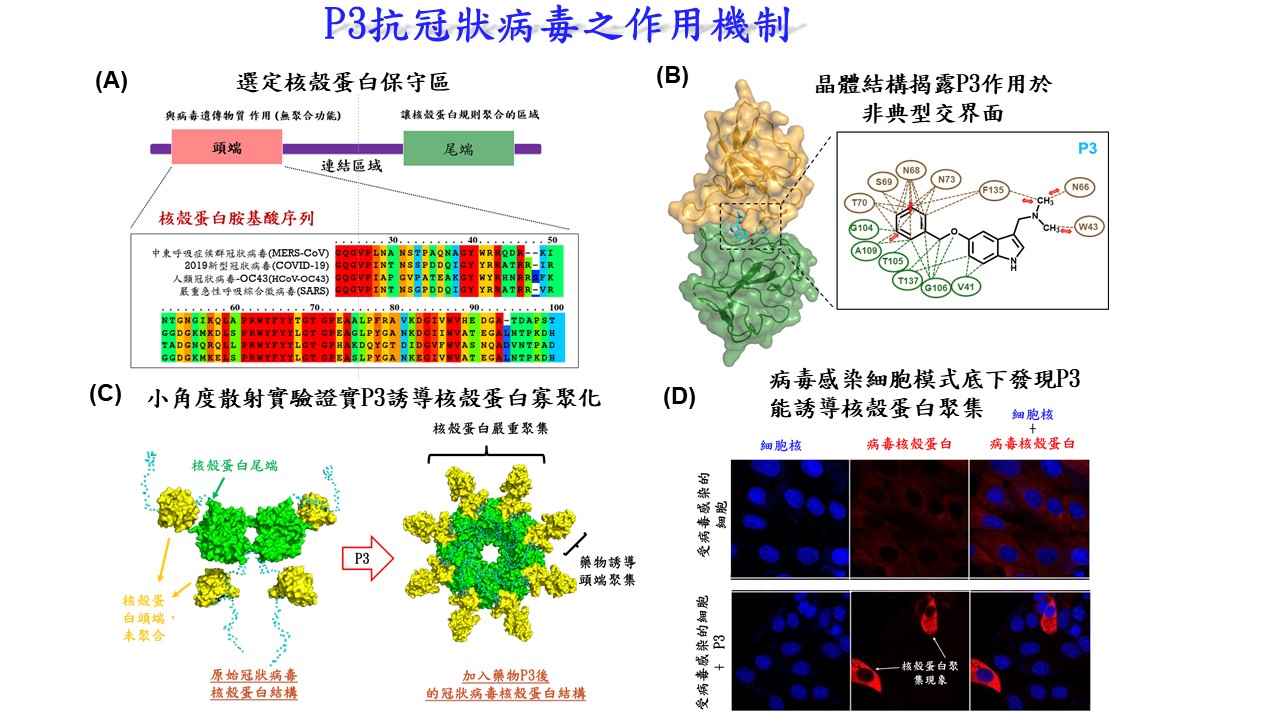
| 技術簡介 | 透過穩定蛋白質交界面交互作用力(protein−protein interaction, PPI)被認為是一具有潛力的藥物開發策略,可應用於治療病毒感染或癌症的疾病上。此類藥物會以直接或間接的方式來穩定蛋白質交界面的作用力,進而改變其蛋白質的寡聚平衡,藉此調節蛋白質自然的生理功能。一般而言,適合藥物靶點的蛋白質交界面會在生理條件下自然形成,而非典型的蛋白質交界面則會在一些特殊環境下產生。雖然有一些藥物都是在確認其效果之後才發現其具有穩定非典型蛋白質交界面的機制。目前為止,尚無直接以非典型蛋白質交界面作為藥物開發策略的成功案例。 |
||
| 科學突破性 | 本技術首度利用「非典型蛋白質交界面」建立一套具有潛力的新藥物開發策略,並鎖定冠狀病毒核殼蛋白,成功開發出具廣效性之抗病毒前導藥物。突破了以往藥物開發過程,具有這些作用的藥物,都是在確效性確定後,回頭建立作用機制時才發現其作用於非典型蛋白質交界面的能力,本成功案例為結構為基礎藥物研發領域上開啟新一頁。 |
||
| 產業應用性 | 藥物開發每年約有數千億的市場規模,本技術成功將全球首創之藥物設計概念導入抗病毒藥物的開發中。此外,透過本技術開發之藥物P3具抗新型冠狀病毒的活性、副作用低、並有結構資訊可供後續藥物優化的依據,期能以最快速度進入市場,作為抗新冠病毒之重要性療法。 |
||
| 關鍵字 | 新冠病毒 廣效性抗病毒藥物 藥物開發策略 非典型蛋白質交互作用 核殼蛋白 結構生物學 虛擬藥物篩選 X-ray晶體結構 小角度散射實驗 蛋白異常聚集 | ||
- 聯絡人
- 侯明宏
- 電子信箱
- mhho@dragon.nchu.edu.tw
其他人也看了