| 技術名稱 | 三維複合幹細胞球體之細胞治療平台開發:以缺血性腦中風治療為例 | ||
|---|---|---|---|
| 計畫單位 | 國立清華大學 | ||
| 計畫主持人 | 黃玠誠 | ||
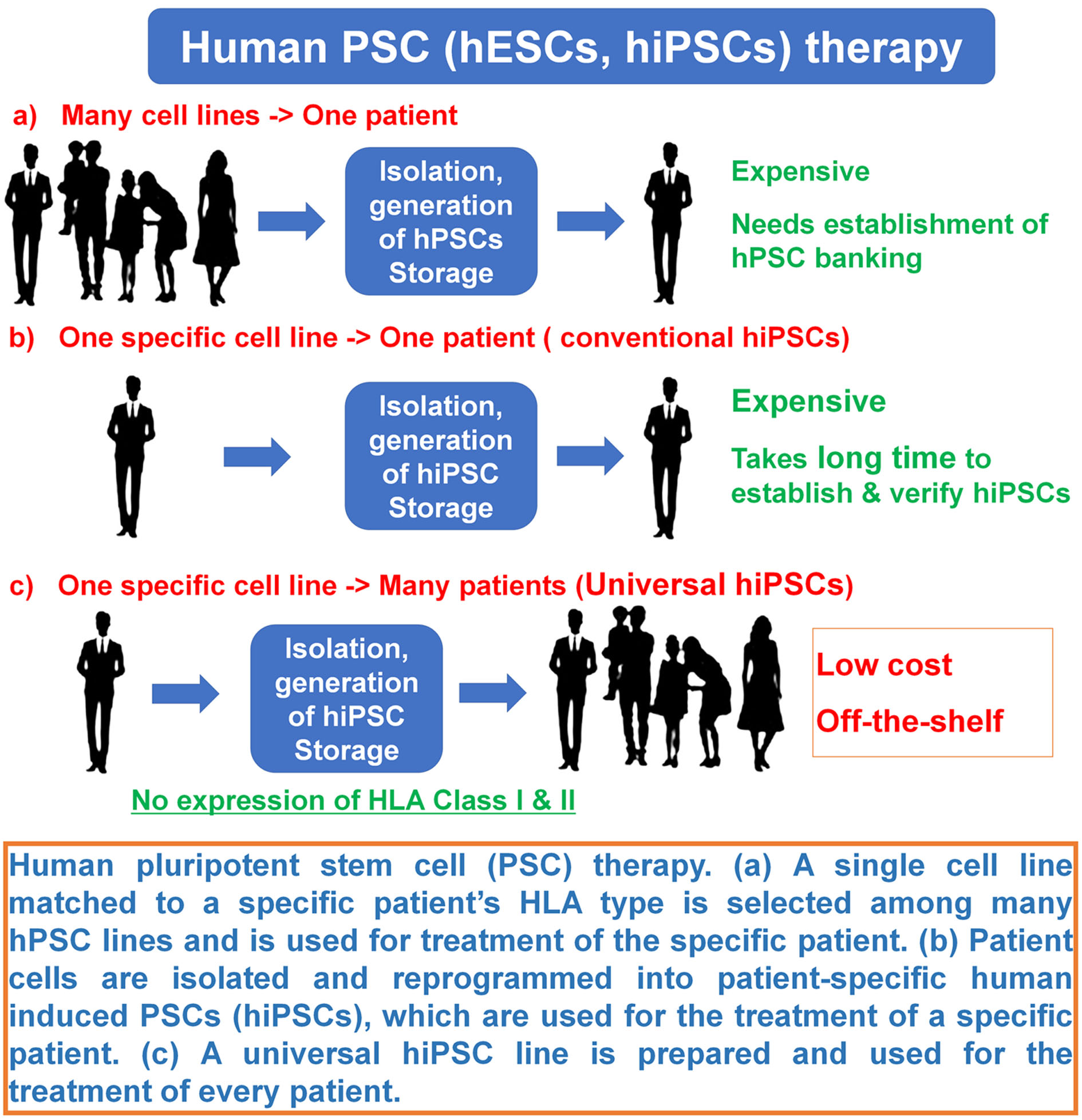
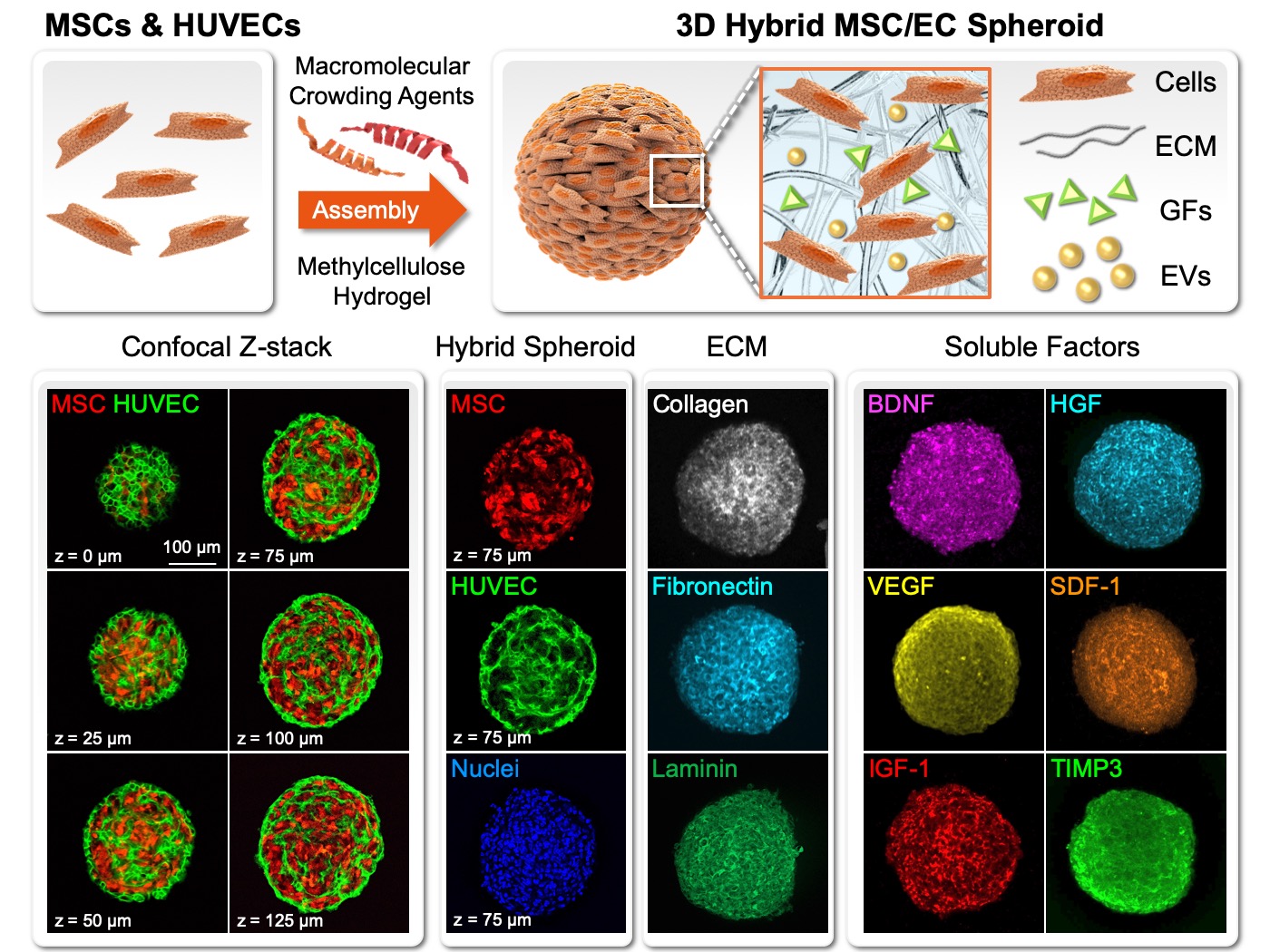
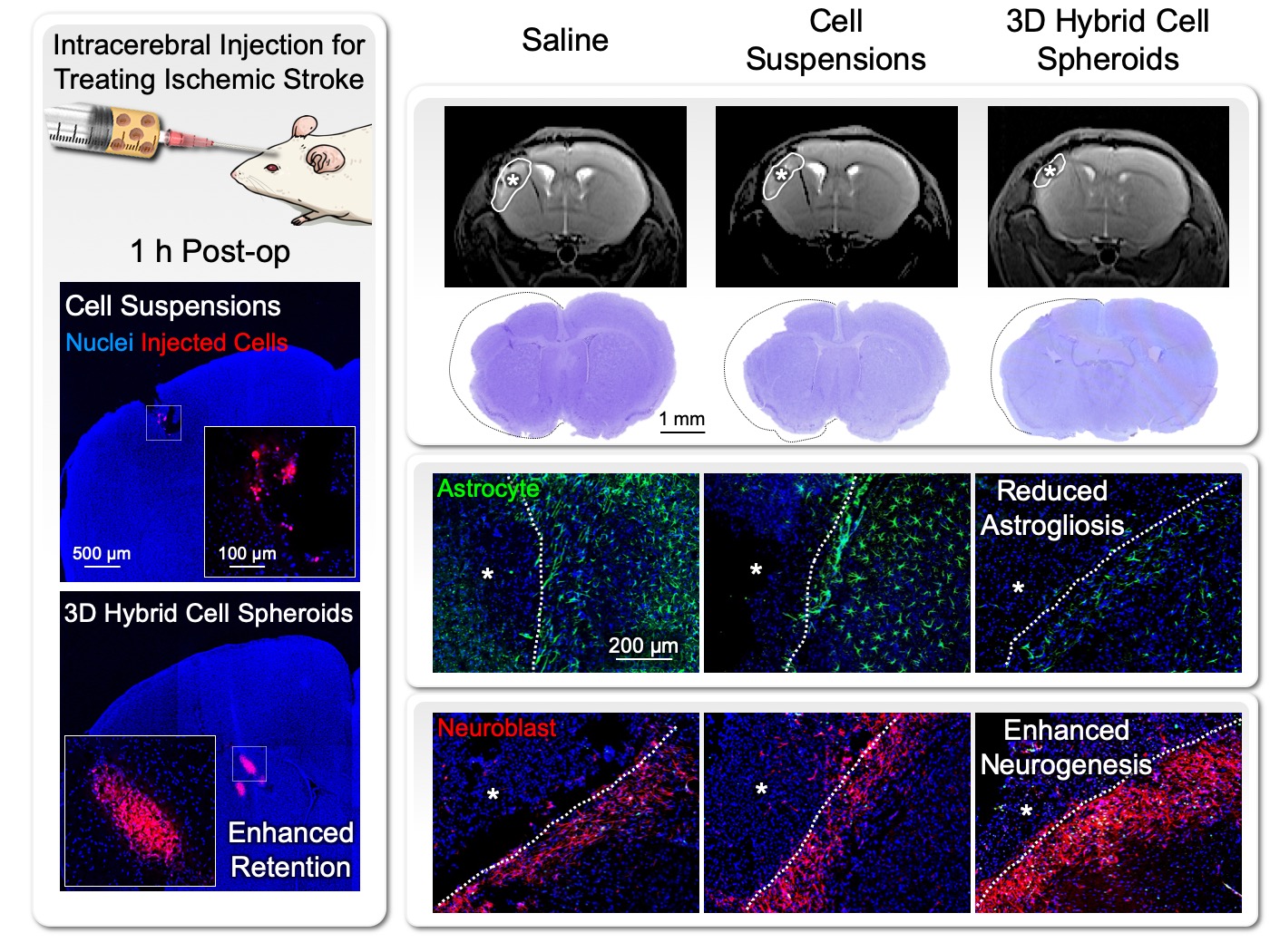
| 技術簡介 | 幹細胞治療為再生醫學領域的重點發展項目,然而儘管已有許多研究證實細胞治療的高度潛能,其臨床應用仍有諸多困難尚待克服。以治療施行的流程為例,幹細胞在體外培養後的收集與注射移植時,往往需面對以下三大難題:(1)移植細胞失巢凋亡(anoikis):在收集細胞時,往往會使用酵素(如胰蛋白酶)使細胞自培養容器上脫附。失去細胞/基質間的連結將引發貼附依賴型細胞(anchorage-dependent cell)的失巢凋亡,因而降低整體療效。(2)移植細胞流失:細胞移植時,往往是以生理食鹽水做為傳輸運輸介質以進行注射。由於酵素作用後的細胞是以單顆懸浮形式存在於食鹽水中,體積較小且缺乏貼附基質,因此注射後大多無法有效停留並集中在病灶處,甚至會沿著注射途徑而流失。(3)移植細胞存活不易:疾病或損傷患部之微環境(如發炎、氧化壓力、缺血、缺氧等)相當不利於細胞的存活。因此即便移植當下細胞可以有效送達病灶處,但若無法改善其存活率,則後續的療效發揮將受到相當大的限制。 |
||
| 科學突破性 | 本研究以甲基纖維素營造低貼附性表面,結合dextran與Ficoll誘發之巨分子擁擠效應,促進細胞製造基質,進而提昇幹細胞旁分泌因子的保存與功效。當移植三維複合幹細胞球體的同時,也將基質與其中所保存的大量旁分泌因子一併送至病灶處,因而不僅提昇了移植細胞的存活率與功能,並有顯著的微環境調節作用。 |
||
| 產業應用性 | 將細胞以本平台製備成三維複合球體的形式,與相同細胞總數的細胞懸浮液比較之下,可以顯著提昇其注射移植後在患部的短期留存率與長期存活率,進而對後續療效做出顯著貢獻,因而在細胞治療相關產業具有相當的產業應用性。 |
||
| 關鍵字 | 幹細胞 細胞治療 三維細胞球體 甲基纖維素 巨分子擁擠效應 旁分泌 缺血性腦中風 神經保護 神經新生 血管新生 | ||
- 聯絡人
- 黃玠誠
- 電子信箱
- chiehcheng@mx.nthu.edu.tw
其他人也看了