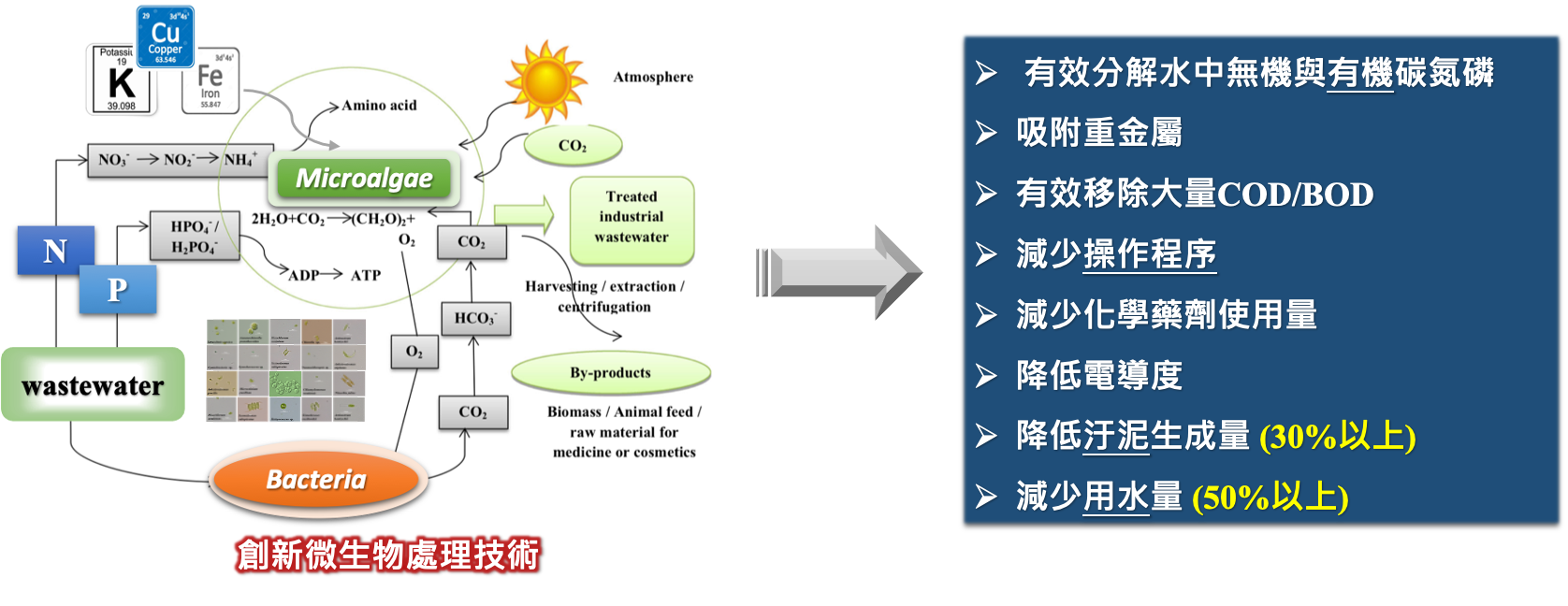
| 技術簡介 |
發現在大腸桿菌中SaCas9與 St1Cas9可以造成如同SpCas9系統之高效 DNA雙股斷裂(DSB),但FnCas12a則否。也證實SaCas9, St1Cas9 and SpCas9 系統之間的sgRNA只會與相對應的Cas9蛋白結合並作用。
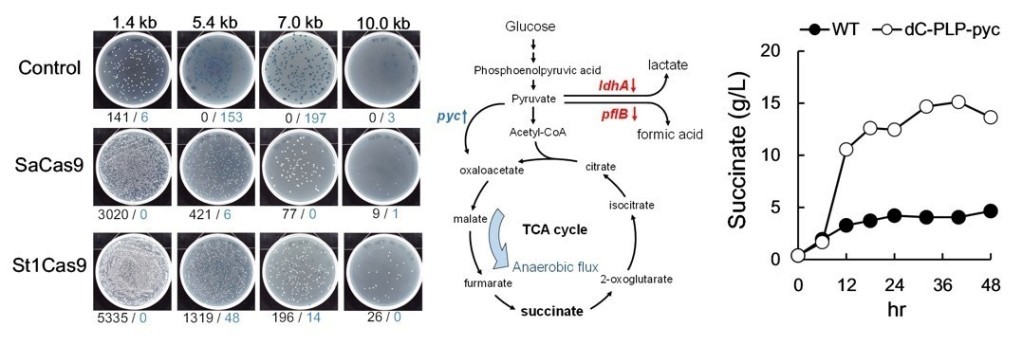
利用St1Cas9可以達成目標將更大的外源DNA片段嵌入大腸桿菌的染色體內的目的。藉由該系統可將原本僅能遷入7kb DNA片段增加至可嵌入約10 kb長的片段於細菌染色體。
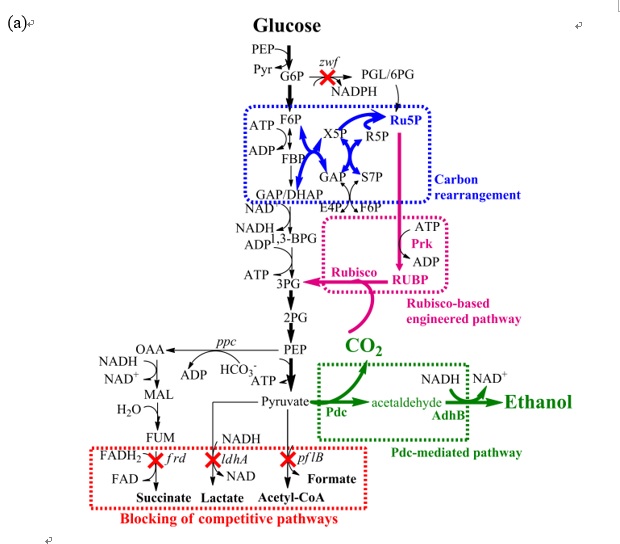
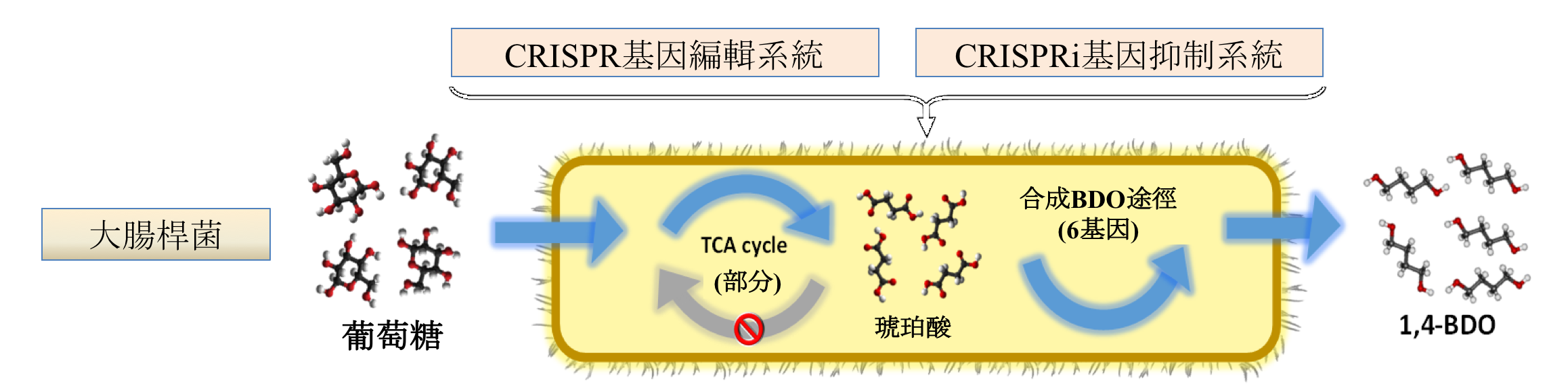
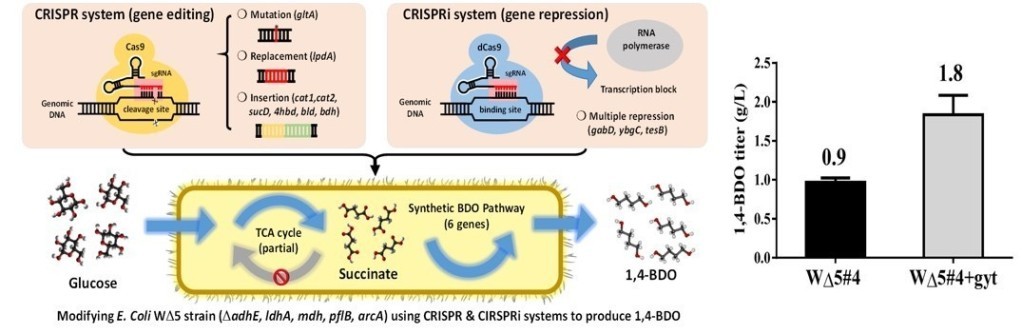
開發結合CRISPR/CRISPRi 兩系統之代謝工程工具並以此強化琥珀酸的產出。野生型大腸桿菌之琥珀酸產量約為0.9 g/L ,經過代謝工程後,移除基因adhE來減少乙醇的產生並加入額外的pyc基因強化琥珀酸生產,結果琥珀酸產量提升約167% (1.5g/L),在進一步減少乳酸、甲酸及乙醇的產量後可將琥珀酸的產量提升至野生型的178% (2.5g/L)。最後經過培養過程的條件優化後,將最終琥珀酸產量提升至在48小時後生產15g/L。
在藍綠菌(細長聚球藻)的研究中CRISPR/Cas9系統可以提升同源互換的效率達到57%,並且確認送入的外源基因正確嵌入目標位置。此外,配合1000 ng之pCas9-NSI質體劑量,也可同時減少模板質體的劑量(250 ng)至一般傳統方法(2000 ng)的1/8,仍可獲得與傳統方法近似的效率。此外,傳統方法進行同源互換時,同源臂的長度一般在800-1000 bp,藉由CRISPR/Cas9系統,可將同源臂長度縮短到400 bp且不影響同源互換效率。
細長聚球藻具有特殊的4倍基因體的性狀,因此在嵌入外源基因或者剔除基因時並不容易將所有的基因體完全替換,在進行剔除基因時會耗費更多的時間在重複進行剔除篩選以及確認基因的工作。使用CRISPR/Cas9系統可以促使外源基因更容易嵌入細長聚球藻之多倍體基因體中,減少剔除基因及完全嵌入外源基因所需耗費的時間,也證明完全被替換後之細菌基因體可以更穩定的較長時間存在於細菌之中。
證實CRISPRi系統可有效的調控基因表現且抑制率可高達99%,另可利用標的基因不同的位置來達到不同程度的抑制效用。同時從細胞生長曲線中並無發現CRISPRi系統會對藍綠菌造成任何負面影響,並其可持續穩定的抑制基因的表現,因此即使在未來需要長期生產也可以利用CRISPRi系統良好的調控基因之表現。
利用CRISPRi系統抑制基因glgc及sdhB,生產琥珀酸的產量將可提升約12.5倍(≈0.58-0.63 mg/L) |